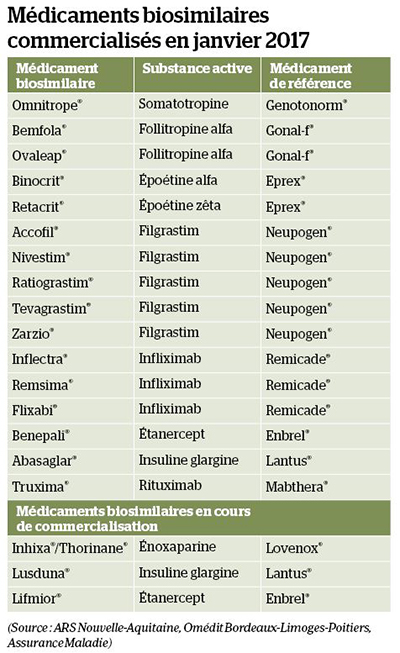
 Plus d’une décennie après la commercialisation en avril 2006 d’Omnitrope® (somatotropine), premier biosimilaire de l’hormone de croissance humaine Genotonorm®, le marché européen des médicaments biosimilaires s’est sans nul doute étoffé. En mai 2016, 21 médicaments de ce type avaient ainsi été homologués par l’Agence européenne du médicament (EMA) et 19 autres étaient en cours d’évaluation en juin 2017. Quant à la France, 15 médicaments biosimilaires y étaient commercialisés en janvier 2017, majoritairement des facteurs de croissance et des anticorps anti-TNF alpha, destinés au traitement d’affections hématologiques ou de maladies à composante inflammatoire (rhumatisme, MICI, psoriasis…), mais aussi des médicaments destinés à d’autres domaines thérapeutiques comme le diabète (voir tableau). Sont actuellement en cours de commercialisation d’autres biosimilaires à base d’étanercept (Lifmior®) et d’insuline glargine (Lusduna®), et deux biosimilaires de l’héparine de bas poids moléculaire Lovenox® : Inhixa® et Thorinane®.
Plus d’une décennie après la commercialisation en avril 2006 d’Omnitrope® (somatotropine), premier biosimilaire de l’hormone de croissance humaine Genotonorm®, le marché européen des médicaments biosimilaires s’est sans nul doute étoffé. En mai 2016, 21 médicaments de ce type avaient ainsi été homologués par l’Agence européenne du médicament (EMA) et 19 autres étaient en cours d’évaluation en juin 2017. Quant à la France, 15 médicaments biosimilaires y étaient commercialisés en janvier 2017, majoritairement des facteurs de croissance et des anticorps anti-TNF alpha, destinés au traitement d’affections hématologiques ou de maladies à composante inflammatoire (rhumatisme, MICI, psoriasis…), mais aussi des médicaments destinés à d’autres domaines thérapeutiques comme le diabète (voir tableau). Sont actuellement en cours de commercialisation d’autres biosimilaires à base d’étanercept (Lifmior®) et d’insuline glargine (Lusduna®), et deux biosimilaires de l’héparine de bas poids moléculaire Lovenox® : Inhixa® et Thorinane®.En outre, fin janvier 2017, deux biosimilaires (Amgevita® et Solymbic®), de l’anti-TNF Humira (adalimumab), dont le brevet de protection expire en 2018, ont reçu un avis positif du Comité des médicaments à usage humain (CHMP) de l’EMA. Et il en a été de même en avril 2017 pour un nouveau biosimilaire d’Enbrel® (Erelzi®), ainsi que pour deux biosimilaires de Mabthera®, Rixathon® et Riximyo®. La concurrence promet d’être particulièrement rude en oncologie, avec l’annonce récente par le laboratoire Amgen de développer des biosimilaires d’Herceptin® (trastuzumab), dont le brevet est tombé en 2014, ainsi que d’Avastin® (bévacizumab) et d’Erbitux® (cétuximab). Est par ailleurs visé en ophtalmologie l’anti-VEGF Lucentis® (ranibizumab), proposé pour le traitement de la DMLA néovasculaire, et qui perdra son brevet en 2022.
Un marché en forte croissance, mais encore de faible ampleur en France
Le marché des médicaments biosimilaires est en forte croissance en France : plus 32 % entre 2012 et 2016 avec un montant de 206 millions d’euros pour les ventes en 2016 selon les données du GERS (Groupement pour l’élaboration et la réalisation de statistiques) (1). La même tendance est observée en médecine de ville avec un accroissement de 26 % en volume et de 19 % en valeur pour la période 2012-2016 (2). Néanmoins, il convient de relativiser ces chiffres, car s’il est indiscutablement en essor et intéresse un nombre très important de laboratoires dans le monde, le marché des biosimilaires ne représente encore que moins de 3 % du montant global des ventes de biomédicaments en médecine de ville en France. Dans ce marché encore restreint, trois médicaments biosimilaires des Laboratoires Sandoz arrivent en tête des ventes : Omnitrope® (somatotropine), Zarzio® (filgrastim) et Binocrit® (époétine alfa).À quelle vitesse et à quel niveau l’utilisation des médicaments biosimilaires va-t-elle se diffuser dans notre pays ? Il semble, en fait, difficile de répondre à cette question vu le faible recul d’utilisation des médicaments biosimilaires, dont les premiers étaient réservés à des maladies relativement rares traitées par des spécialistes hospitaliers. Beaucoup d’experts pensent que c’est la place faite aux biosimilaires d’anti-TNF alpha, dont les premiers Inflectra® et Remsima® (infliximab), ont été commercialisés en septembre 2013, et peut-être plus encore le succès des biosimilaires d’insuline glargine qui permettront de mieux cerner l’avenir des biosimilaires en France. Avec le diabète, c’est en effet une maladie très fréquente et prise en charge en ville qui est désormais concernée.
Des enjeux économiques importants
Les choses sont, en réalité, complexes. Il est clair que les pouvoirs publics espèrent développer les biosimilaires, non seulement pour résoudre d’éventuels problèmes d’approvisionnement toujours possibles avec les biomédicaments, car ils sont difficiles à fabriquer, mais surtout pour faire des économies de santé. Plus onéreux que les médicaments classiques, les biomédicaments représentent, en effet, à eux seuls un quart de l’ensemble des dépenses de médicaments. Or, beaucoup de brevets de biomédicaments vont parvenir à expiration dans les années qui viennent. Si le prix des biosimilaires était abaissé de 20 à 30 % en comparaison de celui des biomédicaments princeps, comme le souhaitent les autorités sanitaires, et que, de plus, leur arrivée contribuait à faire baisser le prix des biomédicaments de référence, ce qui est clairement un objectif recherché, des économies importantes seraient engendrées. De fait, l’Agence nationale de sécurité des médicaments et des produits de santé (ANSM) estimait en 2016 que les médicaments biosimilaires représentent un marché européen potentiel de plusieurs dizaines de milliards d’euros (2). Certains économistes comme Claude Le Pen (université Paris-Dauphine), espèrent grâce à ces médicaments des économies de 500 millions à un milliard d’euros par an en France. Pour le moment, on reste toutefois loin de la part de marché de 30 % de biosimilaires visée par certains spécialistes pour les 5 à 10 ans à venir. Et, en 2017, les biosimilaires feront tout au plus économiser 30 millions d’euros en France, estime Florence Thesmar, spécialiste en économie de santé qui a réalisé une étude sur ce thème pour le journal « Les Échos » (1).Des obstacles liés à un contexte juridique encore flou
Certains de ces freins sont liés à une méconnaissance des effets de ces médicaments, à une probable réticence d’administration par les prescripteurs ou de prise par les patients. S’il est allégé par rapport à celui des médicaments princeps, le développement des biosimilaires est aussi plus exigeant que pour les génériques (voir encadré). Néanmoins, c’est surtout le contexte juridique, insuffisamment clair, qui pourrait freiner l’emploi de ces médicaments.Certes, la dernière loi de financement de la Sécurité sociale 2017 semble, en effet, élargir le concept d’interchangeabilité et de substitution entre biosimilaire et biomédicament, par rapport à la précédente loi de 2014 (3). Mais, aucun décret d’application n’est encore publié. Ce qui rend son interprétation délicate. Les questions posées sont ainsi de savoir s’il est légitime de passer à un biosimilaire chez un patient stabilisé sous médicament de référence et quand un prescripteur peut s’opposer à la substitution par le pharmacien. Prudente, l’ANSM admet dans son rapport sur les médicaments biosimilaires de 2016 que « le choix reste libre entre deux médicaments (biologique de référence ou biosimilaire) en l’absence de traitement antérieur identifié » et rappelle « qu’il n’est pas souhaitable pour des raisons de sécurité et de traçabilité de modifier la spécialité initiale par une autre, sans garantie ». Le patient devra, dans tous les cas, selon l’ANSM, être informé de la prescription du biosimilaire et donner son accord à cette interchangeabilité (2). Et il devra être bien suivi, notamment pour déceler des réactions d’immunogénicité, pas toutes prévisibles, le biosimilaire ayant un processus de fabrication différent de celui du biomédicament princeps. Un plan de gestion des risques est d’ailleurs prévu pour tout nouveau biosimilaire.
Certaines mesures incitatives ont été mises en place en France pour favoriser la prescription biosimilaire. Ainsi, la nouvelle ROSP (Rémunération sur objectifs de santé publique), proposée aux médecins généralistes, retient-elle désormais comme indicateur la prescription de biosimilaires d’insuline glargine. Des experts comme Florence Thesmar jugent cependant qu’il faudrait, pour encourager de manière plus importante les prescriptions de biosimilaires, aller plus loin en mettant en place des rémunérations spécifiques pour les pharmaciens, en instaurant des quotas de prescription par molécule comme cela a été fait en Allemagne, pays où ces médicaments sont bien plus utilisés. Affaire à suivre.
1) Les Échos-Études. Les médicaments biosimilaires en France à l’horizon 2020. Enjeux et perspectives d’un marché
stratégique. Mai 2017.
(2) ANSM. État des lieux sur les médicaments biosimilaires. Rapport. Mai 2016.
(3) Loi n° 2016-1827 du 23 décembre 2016 de financement de la Sécurité sociale pour 2017. JORF n°0299 du 24 décembre 2016, texte n° 1.
À la différence des génériques, les médicaments biosimilaires n’ont pas des caractéristiques identiques mais seulement équivalentes en termes d’innocuité et d’efficacité au médicament princeps de référence.
Ce en raison de méthodes de fabrication différentes de la substance active.
Ceci explique que leur développement clinique, qui requiert, à la différence des génériques, des études précliniques, de toxicité, d’efficacité et de tolérance chez l’homme, nécessite en moyenne 7 à 9 ans (1). Le dossier d’autorisation de mise sur le marché (AMM) se fait par comparaison au princeps et doit prouver qu’il n’existe pas de différences thérapeutiques significatives entre biomédicament biosimilaire et princeps. En outre, le biosimilaire doit démontrer qu’il n’accroît pas le risque d’immunogénicité. Et la sécurité de ces médicaments fait l’objet d’un suivi continu après autorisation (1, 2).
Des extrapolations d’indications, pour lesquelles des études n’ont pas été réalisées, sont possibles au vu de justifications scientifiques, lorsqu’a été démontré le caractère équivalent du biosimilaire au médicament de référence. La demande d’AMM se fait habituellement au niveau de l’EMA suivant la procédure d’enregistrement centralisée.
(1) Communication du Dr Pascal Paubel. Actualités sur les biosimilaires. 1re Journée régionale des pharmaciens hospitaliers. 12 janvier 2017.
(2) ANSM. État des lieux sur les médicaments biosimilaires. Rapport. Mai 2016.

Article précédent
La révolution du microbiote intestinal
Article suivant
FODMAPs : une hypothèse qui fermente
L’atout télémédecine
Patients fragiles et pré-fragiles : mission prévention
Les nouvelles recommandations de la SPLF
Les objets connectés vont-ils vraiment « révolutionner » la santé ?
Femmes à couper le souffle
Protection masculine ou manque de sensibilisation ?
Le serment de Galien et ses ancêtres
Un SESAM pour apprendre la médecine
Une nouvelle ère thérapeutique
Galien : J – 10
Le cerveau du cerveau
Les Européens à cœur ouvert
Regards sur l’œil du diabétique
Le cœur high-tech
Quand la réalité dépasse la fiction
PDA cherche cadre réglementaire
Des barrières de sécurité
La peau en danger
La BPCO tue 5 fois plus que la route
Une révolution dans le monde de la pharmacie
Deux types dans le viseur !
Les patients diabétiques bientôt tous connectés ?
À la recherche d’antalgiques puissants et bien tolérés
Le rouge de la honte
Galien : la comparaison « Nobel »
HTA : peut mieux faire
De la magic bullet au nanomédicament
Imaginer la cardiologie de demain…
Un leitmotiv : arriver à la « Aids-Free Generation »
Les clés d’une prise en charge optimale
Cap or
Ces cinq années qui ont permis de dompter l'hépatite C
Une révolution annoncée : voir au lieu d’écouter
La révolution du microbiote intestinal
Dix ans après : de plus en plus de champs thérapeutiques concernés
FODMAPs : une hypothèse qui fermente
Création du DU « e-santé et médecine connectée »
Le bébé en danger
Des avancées continues
Une arme de pointe en milieu carcéral
L’algorithme, futur bras droit du médecin ?
L’OFSEP : plus de 45 000 patients français à la loupe
Alcool cherche généraliste
Les médecines non conventionnelles à l’étude
Claude Galien, père de la pharmacie
De la fibrillation atriale à l’accident vasculaire cérébral
L'ado a rendez-vous avec la sexualité
L’école avec un grand H
Une avalanche de biomédicaments en rhumatologie
Roland Mehl, père du prix Galien
Menace intérieure sur la peau
Une décennie de révolution
Des données big data à l’immunothérapie dans l’asthme sévère
La montée en puissance des algorithmes
Lever les derniers freins
La peau… à rude épreuve !
Des pansements toujours plus intelligents
Les recommandations mises à jour
Les cinq cancers et l’hépatite C concernés
L’axe cerveau-peau
Quelles vaccinations ?
Zebda, Lhermitte, Garou et les autres
L’odyssée des AOD
Officines : 4 millions de personnes par jour
Les CeGIDD, une approche globale de la santé sexuelle
Big data : code en stocks
Zika : quand la peur permet d’éviter le danger
Lifting dans la gastro-entérite de l’enfant
Les biosimilaires arrivent en force
Maladie d’Alzheimer et syndromes apparentés
La ville sous le signe du cancer
Les nouveaux traitements en ligne de mire
Galien : les derniers crus
Traits de plume
Lombalgie : l’enjeu de la chronicisation
Les quatre de saison
Un passage exaucé par les aumôniers hospitaliers
Grippe : restaurer la confiance
L’homme trahi par sa prostate
La mauvaise e-réputation : prudence et vigilance
L’ASIP propose un guide aux éditeurs de logiciels
Nouveautés d’aujourd’hui, visions d’avenir
Une sécurité obligée
Couvrez cette peau…
Un rôle majeur dans l’organisation des soins
Passer de la cure au care – du soin à l’accompagnement
Alzheimer : des ateliers pour stimuler les patients
Il était une fois le Galien… Le tour du monde en 45 ans
Une évolution technologique fulgurante
Panser… demain !
Le LDL-cholestérol, une cible à privilégier
L’alcool, le fléau de l’hospitalisation
Une recherche clinique tous azimuts
Pharmaco pratique
Accompagner la patiente souffrant d’endométriose
3 questions à…
Françoise Amouroux
Cas de comptoir
Les allergies aux pollens
Pharmaco pratique
Les traitements de la sclérose en plaques