Les mots du patient
- « Le neurologue m’a fait signer un formulaire avant de me prescrire mon antiépileptique ! »
- « Est-il vrai que des médicaments contre l’épilepsie perturberaient la qualité du sperme ? »
- « Mon médecin modifie mon traitement dans l’optique d’une future grossesse. »
- « J’ai appris que le valproate pris par la mère peut entraîner un retard mental chez l’enfant. »
- « Mon fils va être opéré d’une malformation du cœur peut-être induite par l’un de mes médicaments contre l’épilepsie. »
Les points clés
- Administrés durant la grossesse, certains antiépileptiques exposent l’enfant en devenir à des risques iatrogènes de deux natures : anomalies morphologiques congénitales et troubles neurodéveloppementaux post-nataux.
- Le risque dépend de la molécule, de la dose, de la période d’administration.
- Le valproate expose à un risque majeur, reconnu depuis les années 1960 mais insuffisamment pris en compte avant le début du siècle. Le topiramate expose aussi à une iatrogénie préoccupante, comme le phénobarbital, la primidone, la carbamazépine, la (fos)phénytoïne et la prégabaline. L’ANSM a proposé des tableaux hiérarchisant le niveau de risque selon la molécule considérée.
- Le risque associé à l’usage de nombreuses molécules récentes demeure toutefois insuffisamment documenté - ce qui ne signifie pas qu’il n’y en ait pas.
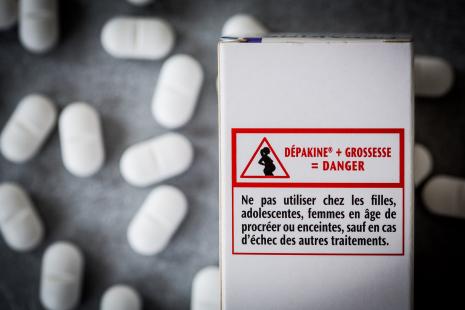
- Des mesures préventives traçant l’information délivrée à la patiente par le médecin encadrent la prescription et la dispensation du valproate comme de ses dérivés et du topiramate.
Épilepsie et antiépileptiques
L’épilepsie recouvre le vaste champ des situations cliniques idiopathiques ou symptomatiques qu’occasionne l’activité hypersynchrone, paroxystique et excessive de populations plus ou moins vastes et interconnectées de neurones, dans les régions corticales et/ou sous-corticales, les noyaux gris centraux ou le thalamus, dans le cerveau. Elle se caractérise par la survenue de crises comitiales résultant d’une rupture de l’équilibre entre les contrôles inhibiteurs et excitateurs de l’activité neuronale, qui se traduisent par des troubles de la conscience et/ou par des troubles moteurs (convulsions, mouvements spastiques, etc.).
L’incidence de l’épilepsie varie entre environ 17 et 140 cas/100 000 sujets/an : quelque 0,4 à 0,5 million de personnes sont touchées en France par cette maladie qui constitue la première des causes non traumatiques de handicap sévère acquis chez le sujet jeune.
Dans ce contexte, il est connu depuis plusieurs décennies que certains antiépileptiques exposent l’enfant à naître à un double risque : celui de malformations congénitales et celui d’anomalies du développement neurologique, tous deux potentiellement associés.
Ces risques, encore insuffisamment documentés pour la plupart des molécules, justifient des mesures de prévention spécifiques qui impliquent à la fois le prescripteur, l’usager des médicaments et, bien sûr, le pharmacien lors de la dispensation (voir encadré). Ces mesures sont d’autant plus nécessaires que certaines de ces molécules sont utilisées dans des indications non conformes à leur AMM.
L’association d’Aide aux parents d'enfants souffrant du syndrome de l'anticonvulsivant (APESAC, apesac.org), estime qu’il y aurait eu, faute d’une prise en compte suffisamment rapide de cette iatrogénie par l’industrie pharmaceutique et par les autorités de santé, des dizaines de milliers de victimes. En septembre dernier, le tribunal judiciaire de Paris a condamné Sanofi à indemniser une mère et ses enfants handicapés en raison d’une exposition fœtale au valproate pour défaut d’information proactive, maintien sur le marché d’un produit défectueux et faute de vigilance ; d’autres suites, notamment pénales, pourraient être données. Quelque 1 500 familles seraient concernées en France.
Valproate : un cas d’école
Prescrit en neurologie (épilepsie), en psychiatrie (maladie bipolaire) et, hors AMM dans d’autres indications (migraines, douleurs neuropathiques, etc.) depuis les années 1960, le valproate bénéficie d’un important recul sur son action thérapeutique comme sur l’iatrogénie attachée à son usage durant la grossesse. Presque quarante ans plus tard, en France, une enquête confiée à l’Inspection générale des affaires sociales (IGAS) a abouti à la diffusion en 2016 d’une synthèse édifiante témoignant du retard à la prise de décision visant à limiter ce risque - et confirmant aussi que la constatation de la tératogénicité de certains antiépileptiques n’avait rien de récent.
S’agissant du valproate, la première malformation majeure chez le nourrisson fut publiée en 1981 ; son action tératogène chez l’animal étant alors déjà démontrée. D’autres publications suivirent : ainsi, ses effets les plus visibles étaient décrits dès le début de la décennie 80 dans plusieurs pays et, dès 1982, le centre pour le contrôle et la prévention des maladies américain (CDC) d’Atlanta ouvrit un registre des grossesses exposées à ce médicament pour mieux cerner le danger. Durant les années 1980 et 1990, des embryofœtopathies dose-dépendantes attribuables à divers antiépileptiques alors banalement prescrits furent documentées et toutes pointèrent le rôle préoccupant du valproate : elles prouvèrent qu’anomalies cardiaques, rénales, des membres, de la colonne vertébrale (spina bifida) et du visage affectaient un peu plus de 10 % des enfants exposés in utero (augmentation importante du risque dès 600 mg/j, sans dose seuil minimale l’excluant). Pour s’en tenir ici à la France, 425 à 450 enfants seraient nés, vivants ou morts, porteurs de malformations congénitales associées au valproate entre 2006 et 2014.
C’est à partir du début des années 2000 que des anomalies neurodéveloppementales, plus discrètes, furent associées à l’usage de cette molécule : leur détection resta tardive car ces effets se manifestent à distance de la naissance et car les registres enregistrant les malformations congénitales ne suivent de toute façon pas le devenir des bébés au-delà de leur première année de vie. Environ 40 % des enfants exposés in utero au valproate présentent un retard psychomoteur et/ou un trouble du spectre de l’autisme et/ou un trouble déficitaire de l’attention avec ou sans hyperactivité (TDAH). À la différence des autres organes, le cerveau demeure sensible aux agents tératogènes jusqu’à la fin de la grossesse, et même après la naissance : les fœtopathies peuvent entraîner un retard neurodéveloppemental. Si le surrisque de survenue de troubles cognitifs et de troubles comportementaux n’a été confirmé par des études prospectives qu’en 2009, l’IGAS considère toutefois que, dès 2004, l’accumulation de signaux alarmants aurait justifié la diffusion d’une information à l’attention des prescripteurs comme des patientes. Il aura cependant fallu attendre 2006 pour que le valproate soit « déconseillé » en cas de grossesse. Plus tard, en 2014, un arbitrage européen a colligé l'ensemble des données et, finalement, abouti à de nouvelles conditions de prescription et de délivrance des spécialités à base de valproate et de ses dérivés (divalproate, valpromide).
Des malformations congénitales diversifiées
La survenue d’anomalies morphologiques constitue le risque le plus évident associé à l’usage d’antiépileptiques durant la grossesse. Parmi ces anomalies, citons notamment l’absence totale ou partielle d’un organe (rein, cerveau), une anomalie de fermeture du tube neural, avec notamment spina bifida (valproate avant tout, carbamazépine), des malformations cardiaques (valproate, phénobarbital, phénytoïne), des anomalies faciales diverses (carbamazépine, topiramate, phénobarbital, phénytoïne) dont notamment divers types de fentes oro-faciales - tel un « bec-de-lièvre » - (valproate, carbamazépine, topiramate, phénobarbital), une microcéphalie (topiramate, phénobarbital, phénytoïne), des malformations du système nerveux central (prégabaline, à confirmer), une craniosténose (prégabaline, risque à investiguer), des anomalies dans la formation des membres (valproate), un hypospadias (valproate, topiramate), une coarctation aortique (prégabaline, à confirmer).
11 % des enfants exposés in utero au valproate ont un risque de malformation majeure
Ces anomalies sont conditionnées par la molécule administrée mais aussi par la dose – sans que l’on puisse déterminer des seuils en deçà desquels il n’y aurait aucun risque – et par la période d’utilisation durant la grossesse (risque maximal jusqu’à la semaine 16, du moins pour les anomalies morphologiques).
30 % à 40 % des enfants exposés au valproate ont un risque de survenue de troubles neurodéveloppementaux
Une polythérapie expose à un risque accru, là aussi fonction des molécules associées et des doses, mais le nombre de combinaisons susceptibles d’être prescrites rend l’évaluation de chacune d’elles impossible.
Les anomalies morphologiques sont conditionnées par la molécule administrée mais aussi par la dose
Il faut noter que si une supplémentation en acide folique ne prévient pas les anomalies de fermeture du tube neural induite par le valproate et par ses dérivés, elle n’en reste pas moins préconisée (ANSM 2023) avant la conception et en début de grossesse (le suivi pré — et postnatal de l’enfant sera identique, que la patiente en ait ou non bénéficié).
L’Agence nationale de sécurité du médicament et des produits de santé (ANSM) évoque de plus un risque de « récidive » lors de la présence dans la fratrie d’un (ou de plusieurs) enfant(s) atteint(s) d’une malformation congénitale après exposition in utero à un antiépileptique : ce surrisque est identifié notamment pour le valproate, le topiramate, la phénytoïne et le phénobarbital.
Un risque neurologique reconnu plus récemment
Il n’y a que deux décennies que le risque neurologique qu’induit l’imprégnation fœtale par certains antiépileptiques (surtout valproate, mais aussi topiramate ou carbamazépine) a été pris en compte.
Associée à des anomalies du développement du cerveau, la survenue d’anomalies neurodéveloppementales se traduit notamment par des troubles du développement cognitif, par un déficit intellectuel, par un retard dans les acquisitions et les apprentissages, par des troubles du spectre autistique, par un trouble déficitaire de l’attention avec ou sans hyperactivité (TDAH), etc. La diversité de ces troubles et l’absence de données statistiques de référence en population générale rendent difficile, sinon même impossible pour certaines molécules peu prescrites, l’évaluation de leur incidence. Pour cette raison et du fait également du moindre nombre de travaux, les données épidémiologiques restent actuellement moins robustes que celles portant sur les risques morphologiques. Concrètement, il est à ce jour délicat de tirer des conclusions pour la majorité des antiépileptiques commercialisés.
Quoi qu’il en soit, ces troubles ne peuvent pas être diagnostiqués durant la grossesse et ne se révèlent qu’au fil du développement neuromoteur du nourrisson, d’où la nécessité d’un suivi postnatal renforcé et adapté. Comme à l’égard de la survenue de malformations congénitales, le rapport de l’ANSM souligne une possible récurrence : le risque d’avoir un autre enfant atteint d’un trouble neurodéveloppemental est accru lorsqu’un précédent enfant de la fratrie a été atteint.
Les troubles neurologiques ne se révèlent qu’au fil du développement neuromoteur du nourrisson, d’où la nécessité d’un suivi postnatal renforcé
D’autres risques à prendre en compte
S’ajoutent aux risques de malformations congénitales et de troubles neurologiques des risques néonataux non évalués dans le rapport de l’ANSM mais qui méritent d’être suivis : iatrogénie « classique » liée à l’imprégnation par l’antiépileptique (sédation, troubles du champ visuel pour la vigabatrine ; hématotoxicité et hépatotoxicité pour le felbamate ; troubles pondéraux pour le zonisamide, etc.), troubles liés au sevrage une fois l’enfant venu au monde, syndrome hémorragique résultant de l’inhibition de la production de vitamine K maternelle par l’antiépileptique (carbamazépine notamment) et prévenu par l’administration de vitamine K, anomalies phosphocalciques et/ou de la minéralisation osseuse (pouvant nécessiter une supplémentation par vitamine D).
De fortes disparités dans l’échelle des risques
Depuis la publication de son premier rapport (2019), les données actualisées ont permis à l’ANSM de produire en 2023 un nouveau rapport dont l’originalité est de présenter un classement des anticomitiaux en fonction des risques malformatifs et des risques de troubles neurodéveloppementaux. Le suivi mondial confirme que les connaissances dans ce domaine évoluent constamment, d’où une nécessaire prudence : une absence de données ne signifie pas une absence de risques.
Ainsi, durant les quatre années écoulées entre ces deux rapports, le risque associé à l’usage du valproate (et de ses dérivés : divalproate ou valpromide) a été encore mieux documenté, celui de malformation majeure associée à la prise de prégabaline a pu être confirmé et l’accroissement du risque de survenue de troubles neurodéveloppementaux a été validé pour le topiramate et évoqué pour la carbamazépine.
Risques malformatifs et de troubles neurodéveloppementaux : une absence de données ne signifie pas une absence de risques
Le catalogue des antiépileptiques susceptibles d’être administrés à une femme en âge de procréer révèle de fortes disparités dans ces risques selon les molécules.
(Tableau ANSM)
Information et suivi, essentiels
Ainsi, les risques associés à l’usage d’antiépileptiques durant la grossesse doivent impérativement être pris en compte à l’initiation du traitement et expliqués de façon claire et détaillée à la patiente, et ce même en l’absence de projet de grossesse.
Par précaution élémentaire, la patiente devra accepter de suivre un traitement contraceptif lorsqu’une molécule administrée expose l’enfant à venir. La contraception prendra en compte le risque d’interaction médicamenteuse et de moindre efficacité des contraceptifs hormonaux lors de l’association avec certains antiépileptiques qui en augmentent le métabolisme (carbamazépine, oxcarbazépine, eslicarbazépine, topiramate, felbamate, pérampanel, rufinamide, phénobarbital, primidone, phénytoïne). En ce cas, la patiente aura recours à un dispositif intra-utérin (au cuivre ou avec un progestatif) ou à deux méthodes de contraception complémentaires dont une mécanique (ex : préservatif).
Les barbituriques, la primidone, la phénytoïne ou la carbamazépine peuvent aussi diminuer l’efficacité des contraceptifs d’urgence contenant du lévonorgestrel : l’ANSM a publié (2017) des recommandations pour les femmes utilisant ces médicaments (une contraception d'urgence non hormonale, type dispositif intra-utérin au cuivre, peut être placée jusqu'à 5 jours après un rapport sexuel non protégé).
La patiente ne doit jamais arrêter son traitement antiépileptique ou le modifier sans avis médical au vu des risques encourus pour elle (déséquilibre de la pathologie traitée), mais aussi pour l’enfant en développement si elle est enceinte : la survenue de crises comitiales peut avoir des conséquences sévères pour la mère et peut même se révéler fatale pour le fœtus. La patiente consultera donc immédiatement son neurologue ou un médecin si elle est enceinte, si elle croit l’être ou si elle a juste un projet de grossesse.
Précisément, tout désir de grossesse sera anticipé afin d’adapter la prise en charge de l’épilepsie suffisamment à l’avance : le risque de développement de malformations congénitales sous antiépileptique est en effet maximal à une période où la femme ignore le plus souvent encore sa grossesse. Une information détaillée sera donnée lors de la visite préconceptionnelle à la patiente comme à son conjoint : elle portera, entre autres, sur l’adaptation du traitement - ses avantages, ses inconvénients, ses bénéfices pour l’enfant.
Le spécialiste reconsidérera l’intérêt de maintenir le traitement ou de conserver une même stratégie thérapeutique. Il pourra ainsi envisager un sevrage progressif si l’état clinique de la patiente le permet - quitte à réinstaurer le traitement après la grossesse. Il pourra également modifier sa prescription en optant pour une ou des molécule(s) alternative(s) soulevant le moins d’inquiétudes pour l’enfant à naître, en supprimant telle ou telle molécule en cas de polymédication anticomitiale, là aussi de façon temporaire, en prescrivant la dose minimale efficace et en s’appuyant, si possible, sur les taux plasmatiques avec dosage de référence avant la grossesse puis en tout début de grossesse. Ces modifications seront expliquées et justifiées.
La grossesse fera l’objet d’un suivi renforcé et spécialisé, quel que soit le traitement antiépileptique administré, et l’enfant sera lui aussi suivi après sa naissance, et ce durant plusieurs années.
Si les effets indésirables observés lors de la grossesse ou après sont déclarés aux centres régionaux de pharmacovigilance (CRPV), les patientes traitées seront elles-mêmes enregistrées dans les registres spécifiques des bases de surveillance (notamment auprès du Centre de référence sur les agents tératogènes CRAT ou dans le Registre international antiépileptiques et grossesse EURAP) afin de contribuer à l’évaluation des risques.
En post-partum, le spécialiste pourra réinstaurer le traitement anticomitial antérieur à la grossesse, tout en abordant la question d’un éventuel allaitement.
Questions sur ordonnance
Madame Noémie J., 26 ans
Docteur Jean Némard
Neurologue
Madame Noémie J., 26 ans
Lamotrigine :
- semaine 1 et 2 : 25 mg/jour
- semaine 3 et 4 : 50 mg/jour
Dépakine Chrono 500 mg : 1 cp matin et soir
Traitement pour 1 mois.
Nouvelle visite dans un mois.
Madame J. souffre d’une épilepsie partielle qu’ont accompagné il y a quelques années des généralisations secondaires. Le neurologue commence la modification de son traitement par valproate car elle manifeste un fort désir de maternité, s’étant mariée depuis près d’un an et ayant désormais une activité professionnelle stable.
Quels sont les principes actifs ?
La lamotrigine est un antiépileptique indiqué notamment dans le traitement en monothérapie ou en association des épilepsies partielles et généralisées. Son usage est compatible avec une grossesse.
Le valproate de sodium (Dépakine Chrono) est un antiépileptique indiqué dans l’épilepsie généralisée comme partielle (avec ou sans généralisation secondaire), connu pour exposer l’enfant en développement à une iatrogénie très préoccupante. Son usage est contre-indiqué durant la grossesse.
Y-a-t-il des insuffisances et des interactions ?
La substitution entre deux antiépileptiques reste délicate même si son principe est simple : maintien du traitement d’origine et introduction progressive du traitement nouveau, jusqu’à une dose suffisamment active, puis suppression également progressive du traitement antérieur. Elle requiert des semaines et un suivi rigoureux, tant de la part de la patiente que de celle du médecin en raison des interactions cinétiques et des effets indésirables susceptibles de survenir. De nombreuses stratégies de switch sont proposées dans la littérature médicale : elles sont plus ou moins adaptées aux AMM des médicaments qui diffèrent selon les pays. La séquence mise en place ici s’inspire d’un algorithme proposé il y a une vingtaine d’années par des spécialistes américains.
Et les posologies ?
Les doses de lamotrigine sont augmentées par paliers n’excédant pas 50 à 100 mg toutes les 1 à 2 semaines jusqu'à la dose journalière de 200 mg, atteinte ici en deux mois environ. À partir de ce moment, la posologie de valproate sera réduite progressivement, quitte à recourir à la forme buvable, sur 2 à 6 semaines selon le risque de décompensation de la maladie épileptique qui semble assez faible ici car la patiente n’a pas présenté de crise généralisée depuis longtemps. La posologie de la lamotrigine sera quant à elle augmentée pour arriver à 300 mg (cela pourrait être plus, selon la dose de valproate qui était prescrite : ici, elle est de 250 mg/j). Une fois le valproate supprimé, la posologie de la lamotrigine sera encore augmentée jusqu’à la dose de maintenance cible fixée, a priori, à 400 mg/j chez cette patiente - il est difficile de l’anticiper et souvent nécessaire de l’adapter ultérieurement, tout dépendant de la clinique. L’ensemble de ce processus requiert plusieurs mois d’où la nécessité de l’anticiper.
Les conseils du pharmacien
Le pharmacien insistera, à la suite du médecin, sur la nécessité de veiller au risque d’iatrogénie dermatologique, bien connu avec la lamotrigine.
Nicolas Tourneur, pharmacien
Des dispensations encadrées
L’encadrement de la prescription des antiépileptiques est d’autant plus important que nombre de molécules bénéficient d’indications dans des domaines variés : en psychiatrie, dans le traitement des douleurs, etc. voire dans des contextes non conventionnels sous l’influence notable des réseaux sociaux (ex : topiramate comme amaigrissant). S’agissant ici de la seule question de l’iatrogénie associée à la grossesse :
Valproate et dérivés
- Filles, adolescentes, femmes en âge de procréer, femmes enceintes : prescription initiale annuelle réservée aux spécialistes en neurologie ou en pédiatrie (valproate, valpromide), ou aux psychiatres (divalproate). Renouvellement non restreint. Médicaments nécessitant une surveillance particulière pendant le traitement : la prescription initiale nécessite préalablement le recueil de l'accord de soins de la patiente ; la délivrance ne peut se faire qu'après avoir vérifié la présentation du formulaire annuel d’accord de soin complété par la patiente. Le pharmacien remet la carte patiente, à détacher ou à récupérer à l’intérieur de la boîte, et la brochure d’information patiente disponible sur le site de l’ANSM ;
- Hommes : en janvier 2024, le comité de pharmacovigilance (PRAC) de l’Agence européenne des médicaments (EMA) a recommandé la mise en place de mesures visant à réduire l’exposition au valproate chez les pères dans les trois mois précédant la conception. Pendant le traitement et au moins trois mois après son arrêt, il est nécessaire de mettre en place des mesures contraceptives efficaces, y compris pour la partenaire, et de ne pas faire de don de sperme.
Topiramate
Prescription initiale annuelle réservée aux spécialistes en neurologie ou en pédiatrie pour les filles, adolescentes, femmes en âge de procréer, femmes enceintes. Renouvellement non restreint. Médicament nécessitant une surveillance particulière pendant le traitement : la prescription initiale nécessite préalablement le recueil de l'accord de soins de la patiente ; la délivrance ne peut se faire que sur présentation du formulaire annuel de l’accord de soin signé par la patiente.
Carbamazépine
Pour les filles, adolescentes, femmes en âge de procréer et femmes enceintes : proposition par l’ANSM de mise en place d’une attestation annuelle d’information partagée (2023), mais mise en œuvre non concrétisée à ce jour.
Prégabaline
Médicaments soumis à la réglementation des stupéfiants (ordonnance sécurisée), durée de prescription limitée à 6 mois.
Testez-vous
1. En France, la population de sujets souffrant d’épilepsie est comprise entre :
a) 400 000 et 500 000 ;
b) 40 000 et 50 000 ;
c) 17 000 et 136 000.
2. Comptent au nombre des malformations congénitales les plus décrites sous antiépileptiques :
a) Une anomalie de fermeture du tube neural ;
b) Un syndrome de Down ;
c) Un pied bot varus équin.
3. Le valproate de sodium :
a) Est connu comme susceptible d’induire des troubles congénitaux depuis le début des années 2000 ;
b) Peut être à l’origine d’un spina bifida ;
c) Peut être à l’origine d’un hypospadias.
4. Parmi les antiépileptiques exposant à un risque de trouble neurodéveloppemental reconnu, citons :
a) La lamotrigine ;
b) Le lévétiracétam ;
c) La carbamazépine.
5. Parmi les antiépileptiques n’exposant pas à une augmentation du risque global de malformations, citons :
a) La prégabaline ;
b) Le topiramate ;
c) Le lévétiracétam.
Réponses : 1. a) ; 2. a) ; 3. b) et c) ; 4. c) ; 5. c).

Cyclone Chido
Mayotte : l’aide aux pharmaciens s’organise
À la Une
Tériparatide, étanercept, adalimumab : avis favorable à la substitution biosimilaire par le pharmacien
Expérimentation
Une notice dématérialisée pour certaines boîtes de médicaments en 2025
Bilan 2024
Un avenant conventionnel qui divise