« QUEL EST le point commun entre une prothèse de hanche, une pompe à insuline, un pacemaker, une IRM, des seringues, une paire de béquilles, un fauteuil roulant, des pansements, un robot chirurgical ou un neurostimulateur cérébral ? Au sein des industries de santé, ils appartiennent tous à la même famille : celle des dispositifs médicaux (DM). » Voici comment débute le « Que sais-je ? » sur le dispositif médical, coécrit par les pharmaciens Antoine Audry, directeur des affaires publiques et réglementaires chez Medtronic France, et Jean-Claude Ghislain, directeur de l’évaluation des dispositifs médicaux à l’Agence française de sécurité sanitaire des produits de santé (AFSSAPS). Les auteurs soulignent avec raison l’hétérogénéité de cette catégorie de produits multiformes utilisés comme traitement de pathologie, outil de diagnostic, instrument du soignant ou accessoire essentiel du patient.
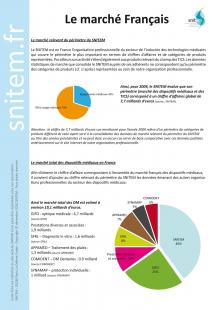
Une hétérogénéité telle qu’il existe au moins six grands syndicats professionnels pour représenter les industriels du DM. Le syndicat national de l’industrie des technologies médicales (SNITEM), couvre le périmètre le plus important (40 %) en termes de chiffre d’affaires et de catégories de produits représentées, principalement hospitaliers. « Il importe de ne pas confondre le périmètre LPP* avec celui du SNITEM, ce dernier n’englobant pas toute la LPP tout en allant également au-delà du périmètre de la LPP. Dans le domaine des dispositifs médicaux, une augmentation de la croissance d’une catégorie de produits peut être due à de multiples raisons. Par exemple, une extension d’indication pour une catégorie de produits donnée ou la conséquence d’un plan gouvernemental. Par ailleurs, l’analyse des différents secteurs révèle une situation contrastée qui, au demeurant, varie suivant les périodes », explique François-Régis Moulines, directeur des affaires publiques, juridiques et de la communication du SNITEM. Ainsi, le syndicat a effectué « une analyse comparative sur 4 ans (2006 – 2009) des chiffres d’affaires réalisés sur les 14 groupes sectoriels composant l’observatoire du SNITEM, qui fait apparaître une décroissance globale continue, avec des taux passant de 5,43 % (2007/2006) à 1,41 % (2008/2007) et à 0,06 % (2009/2008), soit une croissance quasi « flat » entre 2008 et 2009 ». Les autres syndicats professionnels sont le Groupement des industriels et fabricants de l’optique (GIFO – 25 % du marché), le Syndicat de l’industrie du diagnostic in vitro (SFRL – 8 %), le syndicat de l’industrie des dispositifs de soins médicaux (APPAMED – 7 %), le Syndicat national des acteurs du marché de la prévention et de la protection (SYNAMAP – 5 %), le Comité de coordination des activités dentaires (COMIDENT – 5 %).
Dérives.
Le monde du dispositif médical présente d’autres particularités : un statut qui se définit produit par produit et en fonction de son utilisation, une durée de vie qui peut être très courte, des caractéristiques techniques qui n’ont pas forcément de lien avec le bénéfice clinique… Ces ambiguïtés renforcent une impression de flou puisqu’un même produit utilisé dans telle indication sera un DM, mais pas dans telle autre. De plus, lorsqu’il est associé à un médicament, il peut avoir soit un statut de DM (si le médicament a une action accessoire) soit un statut de médicament (qui prévaut donc sur le dispositif).
Certaines dérives ont vu le jour, des fabricants ont demandé le statut de DM pour bénéficier de ses avantages. « Il y a quelques années, on a soupçonné que des demandes pour obtenir ce statut étaient liées au fait que le développement pouvait se faire en deux ou trois ans et que l’évaluation du produit était moins sévère. Aujourd’hui, ce n’est plus vrai, le temps de développement a considérablement augmenté, les évaluations sont de plus en plus exigeantes, le prix est maintenant très encadré par les autorités », explique Damien Peras, président de l’APPAMED et directeur des opérations Urgo Medical France et export.
L’Ordre des pharmaciens (CNOP) a déjà montré du doigt certains médicaments, retirés du marché par l’AFSSAPS et réapparaissant sous le statut de DM. En mai 2007, il s’est même fendu d’une communication sur le sujet : « Un produit est un médicament ou ne l’est pas. Tout ce qui peut être source de confusion pour le consommateur doit être clairement écarté. » Cependant, Damien Peras rappelle aussi qu’il y a eu des reclassements effectués par l’AFSSAPS à la demande du ministère de la Santé. « Au vu de leur utilisation et de leur mode d’action, des produits ont été reclassés. C’est le cas de Pangène, un hémostatique de collagène utilisé à l’hôpital, passé du statut de médicament à celui de dispositif. »
Sécurité et accompagnement.
En France, de manière générale, le dispositif médical ne fait pas partie du monopole pharmaceutique. Néanmoins, « plus de 80 % des DM sont gérés dans l’environnement de la pharmacie, parce qu’ils sont prescrits et figurent sur la même ordonnance que les médicaments », précise Damien Peras. C’est finalement à chaque fabricant de choisir un circuit de distribution plutôt qu’un autre. Chez Urgo, le circuit pharmaceutique est largement privilégié parce qu’il signifie sécurité et accompagnement du patient par un professionnel de santé.
Hors monopole pharmaceutique, les DM n’ont pas besoin d’une autorisation de mise sur le marché pour être présentés à la vente mais d’un marquage CE, délivré par un organisme certifié et notifié. En France, le seul organisme reconnu pour délivrer ce sésame est le LNE-G/MED, désigné et contrôlé par l’AFSSAPS. Contrairement à l’AMM, dont la responsabilité repose sur l’AFSSAPS, le fabricant est responsable du marquage CE et donc de son produit. L’Agence du médicament intervient plus tard dans le processus, lors du suivi et de la surveillance du DM, sauf si des essais cliniques sont conduits en France. Ce marquage CE, dont le but est de permettre la libre circulation des DM dans la communauté européenne, possède plusieurs niveaux d’exigence. La classe I correspond aux DM présentant un faible degré de risque, la classe IIa à un risque moyen, la classe IIb à un risque potentiel élevé et la classe III à un risque potentiel très sérieux. À noter que les DM de classes IIB et III doivent faire l’objet d’une communication auprès de l’AFSSAPS lors de leur mise en service**.
Prix limites de vente.
De plus, de nombreux dispositifs bénéficient d’une prise en charge par l’assurance-maladie. Soit de manière automatique parce qu’ils correspondent à la description des produits entrant dans la LPPR, soit après dépôt d’une demande et obtention de leur prise en charge. « Si le produit correspond aux caractéristiques de la liste des produits et prestations remboursables, il obtient automatiquement le remboursement correspondant. C’est une facilité réglementaire qui n’induit pas forcément la qualité et qui ne pousse pas à l’innovation. Si le produit n’a pas de description dans la LPP, il faut faire une demande de remboursement à la CNEDIMTS. Tout le problème repose sur l’évaluation du DM, car on nous demande encore trop souvent des études randomisées en double aveugle, ce qui n’est évidemment pas possible pour nombre de DM, comme les dispositifs implantables, par exemple. »
La procédure ne s’arrête pas là, l’industriel doit ensuite faire une demande de détermination de prix auprès du Comité économique des produits de santé (CEPS). L’encadrement du prix pour les DM est très différent du médicament mais tend à s’en rapprocher. Au grand dam de Damien Peras. « Beaucoup de DM couverts par l’APPAMED concernent des pathologies lourdes, chroniques, invalidantes, pour lesquelles les laboratoires Urgo considèrent qu’il ne doit pas y avoir de reste à charge pour le patient. Le CEPS nous rejoint sur ce point et a mis en place des limites de prix de vente pour certains DM, qui contraint le pharmacien à ne pas dépasser un certain tarif. » Mais les officines n’ont pas accueilli la mesure d’un bon œil, soulignant que, pour certaines références, cela les obligeait à vendre sans marge, voire à vendre à perte. « Le CEPS a donc également institué un prix maximum de cession pour les industriels. L’APPAMED n’en voit pas l’intérêt. Les DM étant non substituables, il n’y a pas de raison de faire d’accorder des remises aux pharmaciens. Or, le prix du DM en France est le plus bas d’Europe, car on ne lui reconnaît pas ses impacts médicoéconomiques et sanitaires bénéfiques. »
Des produits équivalents.
Les DM sont non substituables car la notion de générique n’est légalement appliquée qu’au seul médicament. « Le droit des marques prévaut. Quand le médecin prescrit un Micropore, le pharmacien ne doit pas délivrer un Urgopore. » Dans les faits, Damien Peras affirme pourtant que la substitution existe. Il ne la condamne pas forcément. « Il existe évidemment des produits équivalents, pour le sparadrap par exemple, dont l’efficacité est fonctionnelle et non clinique. Mais pour un produit technique comme le pansement d’interface, la substitution ne peut exister. Si le médecin prend la décision de prescrire un tel produit, c’est qu’il est convaincu de son caractère clinique et de son efficacité dans le cas particulier de son patient. De plus, deux produits possédant les mêmes caractéristiques techniques et figurant à la même ligne de la LPPR peuvent être totalement différents et sont donc non substituables. » Damien Peras va plus loin en ajoutant : « Il n’y a pas d’intérêt pour le pharmacien à substituer de tels produits car en le faisant il changerait obligatoirement les chances de succès du patient. Faire croire que la substitution est possible sur de tels produits équivaut à tuer l’innovation. On en arriverait à tous fabriquer la même chose pour des coûts les plus réduits possibles. »
Or, la notion d’innovation est essentielle pour les dispositifs médicaux, c’est même l’une de leurs particularités. « Je suis persuadé qu’en France, nous avons des champions du monde du DM. On a des sociétés, des technologies, des savoir-faire qui doivent rester en France, être accompagnés et reconnus. Urgo clame haut et fort qu’il continuera à faire de la recherche en France et à défendre l’industrie française. Mais, pour qu’on puisse continuer à innover, il faut être reconnu et valorisé. »
** Informations tirées du Guide pratique sur le parcours du dispositif médical, édité par la Haute autorité de santé en décembre 2009.




Industrie pharmaceutique
Gilead autorise des génériqueurs à fabriquer du lénacapavir
Dans le Rhône
Des pharmacies collectent pour les Restos du cœur
Substitution par le pharmacien
Biosimilaires : les patients sont prêts, mais…
D’après une enquête d’UFC-Que choisir
Huit médicaments périmés sur dix restent efficaces à 90 %