Prévu par la loi de financement de la Sécurité sociale (LFSS) pour 2022, l’arrêté listant les molécules biologiques pouvant faire l’objet d’une substitution par le pharmacien est paru ce matin au « Journal officiel ». Surprise : la liste est différente de ce qui avait été évoqué en concertation avec les pharmaciens et les patients.
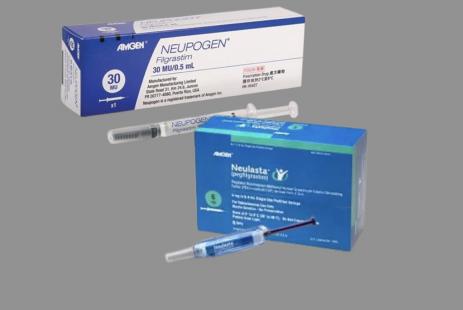
Cela faisait plus de 5 mois que deux molécules étaient évoquées pour la future liste des médicaments biologiques substituables par un biosimilaire : pegfilgrastim (Neulasta) et somatropine (Omnitrope). Surprise, la liste fixée par arrêté parue ce matin au « Journal officiel » fait l’impasse sur la somatropine mais ajoute le filgrastim (Neupogen). « Nous n’avons pas été concertés sur cet arrêté », explique d’emblée Philippe Besset, président de la Fédération des syndicats pharmaceutiques de France (FSPF), tout en rappelant que, de toute façon, « la somatropine est une molécule compliquée à substituer ». À ses yeux, cette liste constitue un ballon d’essai pour lancer, enfin, la substitution biosimilaire par le pharmacien. Mais, prévient-il, « l’ensemble du dispositif devra être retravaillé avec les médecins et les patients, et avec la nouvelle équipe gouvernementale qui sera en place après le 24 avril ».
Pour l’Union des syndicats des pharmaciens d’officine (USPO), la liste reste décevante car « trop restrictive », d’autant que les deux molécules choisies ne sont pas les plus faciles à substituer. « Si on veut que la substitution biosimilaire fonctionne, les choses doivent évoluer. On ne comprend pas pourquoi le Lovenox (énoxaparine) ne fait pas partie de la liste alors que c’est le médicament biologique le plus aisément substituable en pharmacie. » Le syndicat prévoit de nouveaux échanges sur le sujet avec le ministère de la Santé et l’assurance-maladie dès que cela sera possible et appelle à « arrêter d’opposer les médecins et les pharmaciens » avec des listes différentes de biosimilaires à interchanger pour les uns et à substituer pour les autres. « Il faut faire confiance aux professionnels de santé et leur permettre de travailler ensemble plutôt que les uns contre les autres. » En attendant, l’USPO rappelle aux confrères l’importance de se conformer à la loi : « On ne délivre le biosimilaire du Lovenox que sur prescription du médecin. »
De son côté, le think tank Biosimilaires, créé par l’agence Nile et constitué de plusieurs fabricants de biosimilaires et d’associations de patients, s’étonne lui aussi de cette liste qui diffère de celle étudiée en concertation, le filgrastim ayant été ajouté. Il pointe le fait que les deux molécules retenues présentent déjà un taux de pénétration des biosimilaires élevé : 95 % pour le filgrastim et 75 % pour le pegfilgrastim. Or, rappelle-t-il, « l’étude d’impact réalisée en vue de la discussion du PLFSS par les parlementaires précise clairement l’un des objectifs de cette substitution : cibler les biosimilaires pour lesquels le taux de pénétration est a minima 10 points sous la cible des 80 % ». Autrement dit, « rendre substituable le filgrastim et le pegfilgrastim n’a aucun intérêt du point de vue des dépenses d’assurance maladie ». Résultat : « Ni les patients, ni les pharmaciens, ni les médecins, ni les industriels ne comprennent la démarche ni les objectifs. » Le think tank ajoute que les critères pour établir cette liste auraient dû être publiés à l’automne dernier, ce qui n’est toujours pas le cas. Il appelle à la reprise de la concertation avec le ministère et l’ensemble des acteurs.

Dispensation du médicament
Tramadol et codéine sur ordonnance sécurisée : mesure reportée !
Formation continue
Transmission automatique des actions de DPC : les démarches à faire avant le 30 novembre
Relocalisation industrielle
Gel des prix sur le paracétamol pendant 2 ans : pourquoi, pour qui ?
Salon des maires
Trois axes d’action pour lutter contre les violences à l’officine